Abnehmspritze – neue Hilfe gegen Übergewicht
Kurz gesagt
- Der am häufigsten eingesetzte Wirkstoff, Semaglutid, kann zu einem Gewichtsverlust von über 20 Prozent führen.
- Für einen dauerhaften Abnehmerfolg reicht die Abnehmspritze alleine nicht aus.
- Stand März 2024 erstatten die Krankenkassen die hohen Kosten für die Abnehmspritze nicht.
Inhalt
Ist der Weg zum Idealgewicht tatsächlich so einfach? Schließlich sind verschreibungspflichtige Abnehmspritzen wie Wegovy® oder Ozempic® seit Januar 2022 als Mittel zur Behandlung von Übergewicht zugelassen und seit Juli 2023 auch in Deutschland erhältlich. Der Effekt ist beachtlich, die möglichen Nebenwirkungen aber auch. Ein Überblick.
Die Abnehmspritze ist global in aller Munde und so begehrt, dass es auch in Deutschland teilweise zu Lieferengpässen kommt (Gelbe Liste 2024) und gefährliche Fälschungen auftauchen (EMA 2023a, BASG 2023, BfArM 2023). Diabetes-Erkrankte, für die das Medikament ursprünglich entwickelt wurde, haben deshalb immer wieder Probleme, Fertigpens mit dem Wirkstoff Semaglutid (Wegovy® oder Ozempic®) zu bekommen. Gleiches gilt für den Vorgänger-Wirkstoff Liraglutid (Saxenda®), der im Gegensatz zu Semaglutid nicht einmal pro Woche, sondern täglich ins Unterhautfettgewebe (in die Bauchdecke oder den Oberschenkel) injiziert werden muss (Europäische Kommission 2015).
Info – Wegovy & Ozempic
„Wegovy® (Semaglutid) wurde im Januar 2022 zugelassen zur Gewichtsregulierung und ist seit 15. Juli 2023 auf dem deutschen Markt verfügbar. Semaglutid ist außerdem bereits seit 2018 zugelassen zur Behandlung des Diabetes mellitus Typ 2. In dieser Indikation ist es in Deutschland unter dem Handelsnamen Ozempic® auf dem Markt. Wegovy® ist im Unterschied zu Ozempic® auch in den Dosen von 1,7 mg und 2,4 mg verfügbar. Wegovy® kann nicht zu Lasten der gesetzlichen Krankenkassen verordnet werden, da es als sogenanntes Lifestyle-Arzneimittel eingeordnet wurde.“
Quelle: AkdÄ (2023) bzw. Gemeinsamer Bundesausschuss: Arzneimittel-Richtlinie/Anlage II: Einleitung eines Stellungnahmeverfahrens – Ergänzung Semaglutid. Berlin, 8.8.2023. https://www.g-ba.de/beschluesse/6122/
Beide Wirkstoffe sind in Deutschland und Europa nur auf Rezept erhältlich. Voraussetzung für eine Verschreibung ist ein Body-Mass-Index (BMI) über 30, bei Begleiterkrankungen wie Bluthochdruck, erhöhten Blutfettwerten oder Typ-2-Diabetes ein BMI von über 27. Ursprünglich nur als Medikament zur Blutzuckersenkung zugelassen, wurde der sogenannte „Off-Label“-Gebrauch zur Gewichtsreduktion von der Europäischen Arzneimittelagentur EMA für das Produkt Wegovy® im Januar 2022 zugelassen (EMA 2023b), für Liraglutid® bereits 2016 (Pi-Sunyer et al. 2015). Voraussetzung ist, dass die Patienten zuvor konservative Therapieversuche sowie Ernährungsberatung, Bewegungs- und Verhaltenstherapie unternommen haben. Zusätzlich müssen auch Vorerkrankungen der Schilddrüse sowie der Bauchspeicheldrüse ausgeschlossen werden (Europäische Kommission 2023).
Wer bekommt Semaglutid nicht verschrieben?
- Menschen mit einem Body-Mass-Index (BMI) unter 30 (Ausnahme: Patientinnen und Patienten mit einem BMI über 27 und gewichtsassoziierten Erkrankungen)
- Schwangere und Stillende
- Kinder unter 12 Jahren
- Menschen mit einer Allergie gegen Semaglutid oder andere Bestandteile des Mittels
- Personen mit Typ-1-Diabetes, stark eingeschränkter Leber- und Nierenfunktion, schwerer Herzinsuffizienz sowie Retinopathie (diabetesbedingte Netzhautschädigung)
Quelle: ABDATA Pharma-Daten-Service: Beipackzettel von WEGOVY 0,25 mg FlexTouch Injektionslsg. Fertigpen: https://www.apotheken-umschau.de/medikamente/beipackzettel/wegovy-025-mg-flextouch-injektionslsgfertigpen-18299293.html
So wirkt die neue Abnehmspritze
Der am häufigsten eingesetzte Wirkstoff ist derzeit Semaglutid. Er ahmt das Darmhormon GLP-1 (Glucagon-like Peptide-1) nach: Dieses regt die Insulinproduktion an, was hilft, den Blutzuckerspiegel zu senken. Außerdem wird die Glucagonausschüttung gehemmt und über die zentrale Appetitregulation ein verstärktes Sättigungsgefühl signalisiert (Korsatko et al. 2018). Zudem sorgt Semaglutid dafür, dass der Magen langsamer geleert wird. Durch dieses Zusammenspiel und eine dadurch entstehende geringere Zufuhr an Kalorien kann es zu einer Gewichtsabnahme kommen (Hinnen 2017, Blundell et al. 2017).
Wie hoch diese Gewichtsabnahme ist, hängt von unterschiedlichen Faktoren, vor allem aber vom Grad des Übergewichts bzw. der Fettleibigkeit (Adipositas) ab. In einer großangelegten Studie konnten adipöse Nichtdiabetiker unter Semaglutid plus Lebensstilintervention rund 14,9 Prozent Gewicht verlieren (BMI: –5,5 kg/m2), während die Placebogruppe mit alleiniger Lebensstilintervention nur rund 2,4 Prozent schaffte (BMI: –0,9 kg/m2). Ein Drittel (32 %) der Probanden der Semaglutid-Gruppe erzielte sogar einen Gewichtsverlust von über 20 Prozent, im Vergleich zu lediglich 1,7 Prozent in der Placebogruppe. Verglichen mit Liraglutid schneidet Semaglutid damit deutlich besser ab: –12,4 % vs. –5,4 % Gewichtsverlust, jeweils im Vergleich zum Placebo (Hollstein 2021).
Dabei hat nicht nur allgemeines Körperfett den größten Teil des verlorenen Gewichts ausgemacht, auch das metabolisch ungünstige viszerale Fett ging zurück – wenn auch nur leicht um circa 270 Gramm im Vergleich zum Placebo. Die Wissenschaftler bestätigen aber, dass dieser Unterschied bereits ausreicht, um die Entzündungsaktivität – gemessen am Wert des C-reaktiven Proteins – zu reduzieren. Der subkutan injizierte GLP-1-Agonist verbesserte darüber hinaus weitere Parameter wie Blutdruck, Nüchternblutzucker, Lipidwerte und auch insgesamt die Lebensqualität (Tak/Lee 2021, Wadden et al. 2021).
Die positiven gesundheitlichen Auswirkungen bestätigt auch eine Studie, die vom Hersteller selbst finanziert wurde, dem dänischen Pharmakonzern Novo Nordisk. Sie zeigte, dass Semaglutid das Risiko schwerer kardiovaskulärer Ereignisse (wie Tod, Herzinfarkt und Schlaganfall) bei Erwachsenen mit Übergewicht oder Adipositas nach einer Anwendungsdauer von 33 Monaten um 20 Prozent reduziert, auch wenn diese nicht an Diabetes erkrankt sind (SELECT-Studie: Novo Nordisk 2023, ACC 2023).
Laut einer weiteren Studie können vor allem adipöse Patienten mit Herzinsuffizienz von Semaglutid profitieren: Symptome wie Kurzatmigkeit, Erschöpfung oder eingeschränkte körperliche Leistungsfähigkeit wurden deutlich reduziert (Kosiborod et al. 2023). Neu ist die Erkenntnis, dass die GLP-1-Antagonisten auch einen schützenden Effekt vor schweren Lebererkrankungen besitzen und eventuell verhindern, dass eine durch Überernährung verursachte, nicht-alkoholische Fettleber sich zu einer Hepatitis entwickelt (Wester et al. 2023).
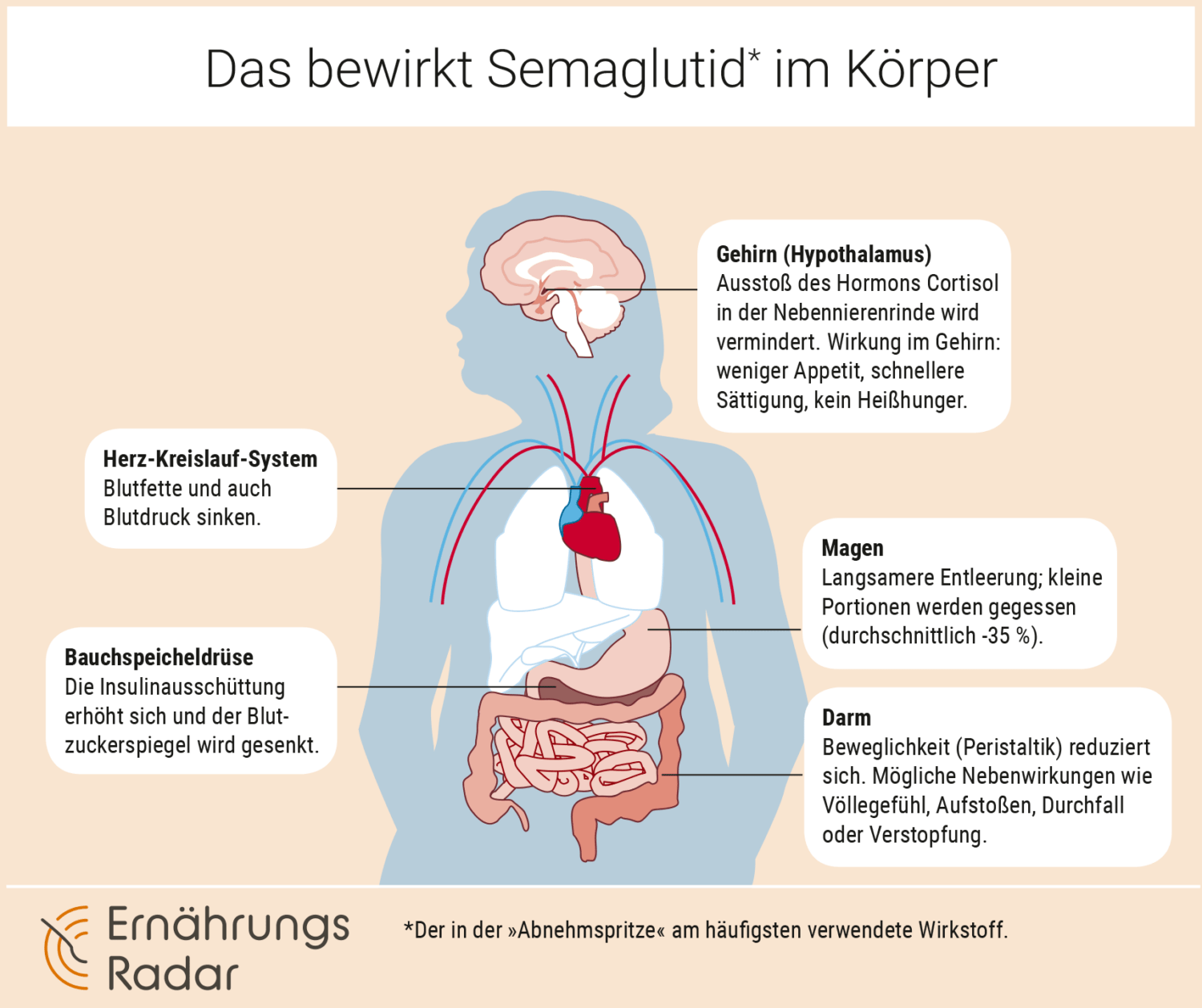
Das bewirkt Semaglutid im Körper
Gehirn (Hypothalamus) – Ausstoß des Hormons Cortisol in der Nebennierenrinde wird vermindert. Wirkung im Gehirn: weniger Appetit, schnellere Sättigung, kein Heißhunger.
Magen – Langsamere Entleerung; kleine Portionen werden gegessen (durchschnittlich -35 %).
Bauchspeicheldrüse – Die Insulinausschüttung erhöht sich und der Blutzuckerspiegel wird gesenkt.
Herz-Kreislauf-System – Blutfette und auch Blutdruck sinken.
Darm – Beweglichkeit (Peristaltik) reduziert sich. Mögliche Nebenwirkungen wie Völlegefühl, Aufstoßen, Durchfall oder Verstopfung.
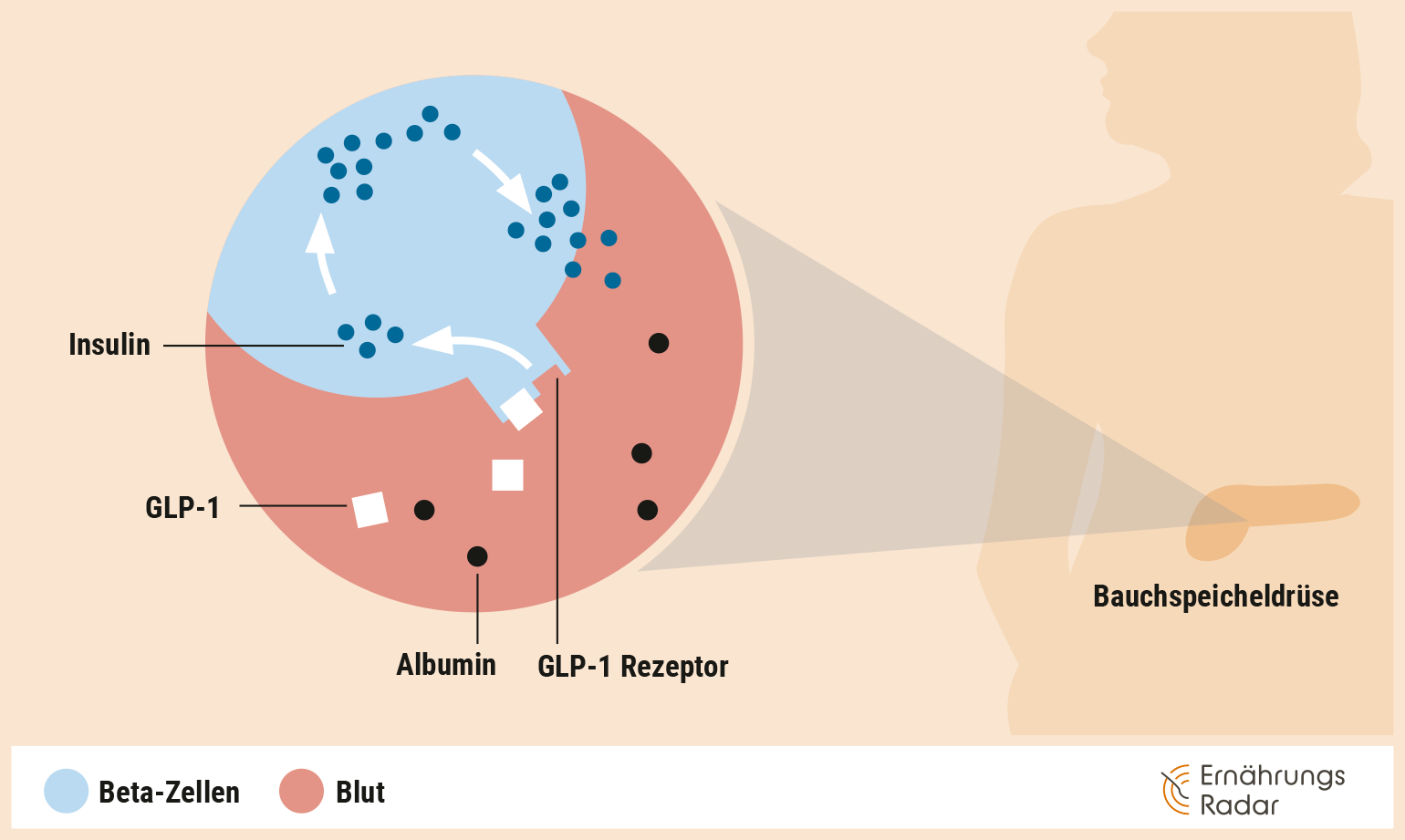
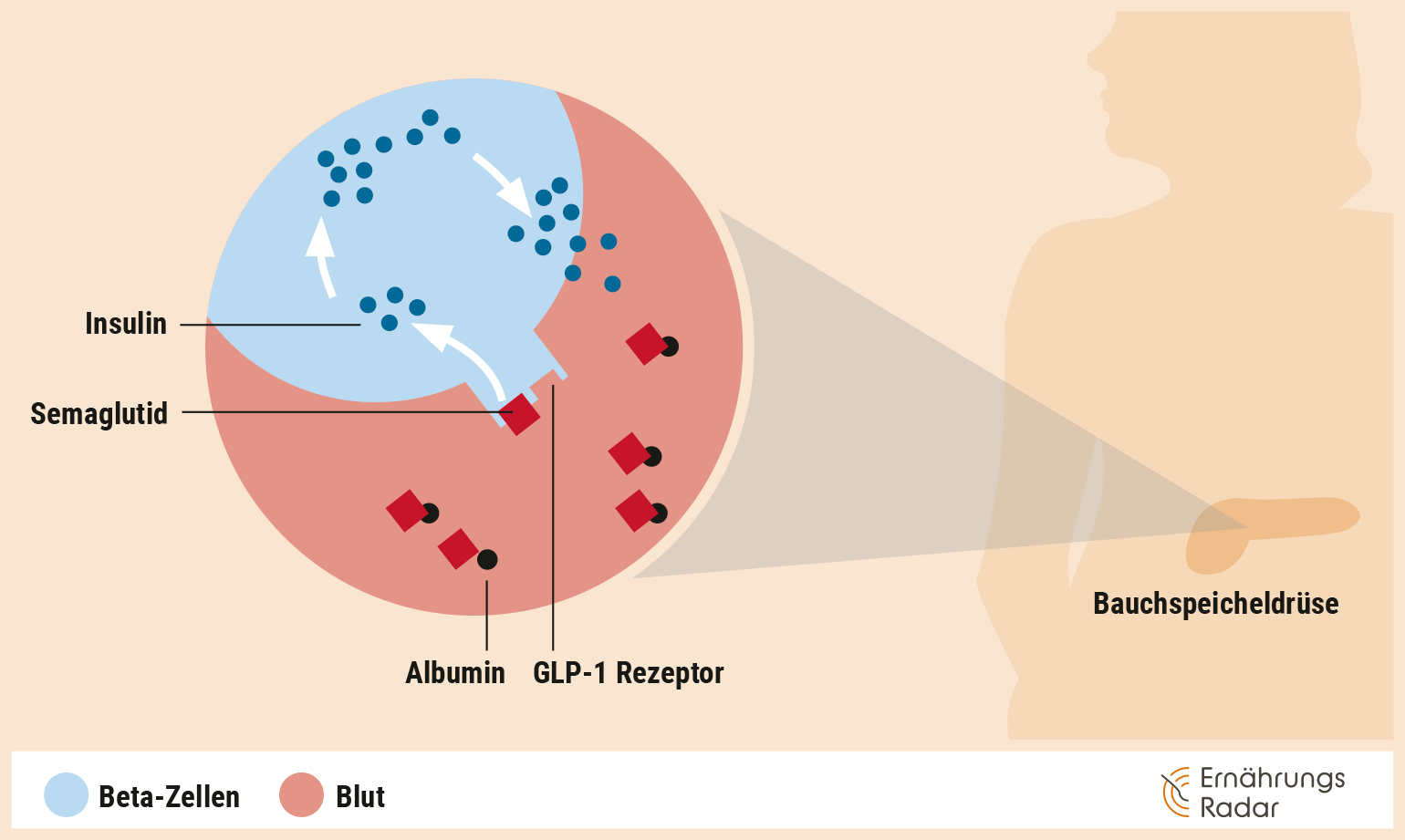
Semaglutid: kein harmloser Appetitzügler
Von den Krankenkassen werden die Kosten von bis zu 4.000 Euro pro Jahr für die Abnehmspritze bis jetzt nicht erstattet (Krankenkassen Deutschland 2024, DAG 2023). So ist die sehr teure und auch lange Therapie nicht für alle Menschen finanzierbar. Jene die es sich leisten können, erwartet nachweislich eine Schlankwirkung von 5 bis 15 Prozent des Körpergewichts durch Liraglutid (Pi-Sunyer et al. 2015) und bis zu 20 Prozent durch Semaglutid (Wilding et al. 2021). Aber auch zahlreiche Nebenwirkungen sind zu befürchten: Verstopfung, Völlegefühl, Übelkeit, Aufstoßen, Blähungen oder Magen-Darm-Beschwerden können mit der Abnehmspritze einhergehen. Selbst wenn diese Beschwerden mit der Zeit nachlassen, ist rund die Hälfte der Patienten davon betroffen (Raccah 2017).
In seltenen Fällen kann es zu Gallenerkrankungen, einer akuten Pankreatitis (Entzündung der Bauchspeicheldrüse), einer Störung der Magenentleerung (Gastroparese) und möglicherweise einem Darmverschluss kommen. Darauf deutet eine Analyse der Datenbank IQVIA (Sodhi et al. 2023) hin. Dies erklärt, weshalb eine ärztliche Begleitung der Anwendung zwingend empfohlen wird.
Zusätzlich ist das Krebsrisiko der beiden Wirkstoffe noch nicht wissenschaftlich untersucht und geklärt. So wurden im Tiermodell GLP-1-Agonisten mit dem Auftreten von Schilddrüsen- und Pankreaskarzinomen assoziiert, auch wenn es im Menschen dafür bislang keine Belege gibt (Liu et al. 2019). Die Befürchtung, Semaglutid hätte schwere Auswirkungen auf die Psyche, konnte eine kürzlich erschienene US-Studie jedoch widerlegen. Die Ergebnisse der Forscher deuten sogar darauf hin, dass Semaglutid Suizidgedanken bei Typ-2-Diabetes oder Adipositas verdrängen kann (Wang et al. 2024).
Ohne Umstellung der Essgewohnheiten funktioniert es nicht
Um den erreichten Abnehmerfolg dauerhaft zu halten, ist eine jahrelange, eventuell sogar lebenslange Therapie mit einem der GLP-1-Agonisten notwendig. Denn das Körpergewicht steigt nach dem Ende der Behandlung wieder an. Dies verdeutlichte eine Studie des Washington Center for Weight Management and Research (Rubino et al. 2021):
Insgesamt 902 Patienten verloren in den ersten 20 Wochen der Behandlung mit Semaglutid über 10 Prozent ihres Körpergewichts. In den darauffolgenden 48 Wochen erhielt nur die Hälfte der Patienten Semaglutid als wöchentliche Injektion, in der anderen Hälfte war diese wirkstofffrei. Die Patienten, die weiter Semaglutid erhielten, verloren von Woche 20 bis Woche 68 noch weitere 7,9 Prozent an Gewicht. In der Placebogruppe kam es hingegen zu einer Gewichtszunahme von 6,9 Prozent.
Die Wissenschaftler prognostizierten den Teilnehmern, dass diese ohne Abnehmspritze innerhalb von drei Jahren ihr Ausgangsgewicht wieder erreichen würden. Dies sei aber auch bei klassischen Diätprogrammen der Fall, so die Aussage. Eine langfristige Umstellung des Lebensstils und der Ernährungsgewohnheiten ist unbedingt nötig, um dauerhaft schlank zu bleiben.
Abnehmspritze 2.0.
Eine noch bessere Abnehmwirkung versprechen neue Wirkstoffe, die zwei oder sogar drei Hormonrezeptoren stimulieren. Tirzepatid beispielsweise aktiviert nicht nur den GLP1-Rezeptor, sondern auch den Rezeptor für das Glukoseabhängige Insulinotrope Peptid (GIP). Bei Studienteilnehmern konnte in den ersten 36 Wochen eine Gewichtsreduktion von 20,9 Prozent erreicht werden. Das ist doppelt so viel wie mit Semaglutid und entspricht den Auswirkungen bariatrischer Operationen, bei denen dauerhaft Teile des Magens entfernt oder die Resorptionsstrecke im Dünndarm verkürzt werden (Aronne et al. 2024).
Tirzepatid wurde in Europa kürzlich unter dem Namen Mounjaro® (Hersteller: Lilly Pharma), ebenfalls als wöchentliche subkutane Injektion, zur Behandlung von Diabetes zugelassen. Die Europäische Arzneimittelbehörde (EMA 2023c) gab kürzlich auch grünes Licht für die Indikation krankhaftes Übergewicht (Adipositas). In Deutschland befindet sich Tirzepatid aktuell (Stand Februar 2024) noch in der Studien- bzw. Zulassungsphase und bereits jetzt ist klar: Es bedarf zwingend einer erfahrenen, ärztlichen Begleitung. Denn eine neue Studie zählt auch hier Nebenwirkungen auf: die häufigsten waren Übelkeit (39,7 % vs. 14,0 % in der Placebogruppe), Durchfall (31,0 % vs. 9,2 %), Verstopfung (23,0 % vs. 6,8 %) und Erbrechen (18,1 % vs. 1,4 %). Daher haben 10,5 Prozent der Tirzepatid-Teilnehmer die Behandlung vorzeitig abgebrochen. In der Placebogruppe waren es nur circa 2 Prozent.
Auch mit Tirzepatid konnte eine Gewichtszunahme nach dem Absetzen nicht verhindert werden. Sie betrug in den folgenden 52 Wochen 14 Prozent, während die Fortsetzung der Tirzepatid-Behandlung zu einer weiteren Gewichtsreduktion um 5,5 Prozent führte (Aronne et al. 2024).
Wissenschaftlich betrachtet gibt es noch mehr Potenzial bei der Forschung an sogenannten Dreifach-Agonisten wie Retatrutid, das alle drei Darmhormone (GLP-1, Glukagon und GIP) kombiniert. Sie wirken auf verschiedene Organe und beeinflussen den Stoffwechsel auf unterschiedliche Arten. So verlieren die Patienten mehr Gewicht, und auch die Nebenwirkungen lassen sich durch diese neue Wirkstoff-Kombination eventuell reduzieren, was wiederum eine höhere Dosierung ermöglichen würde (Eckert 2023).
Ein Blick in die Zukunft
Es ist fraglich, ob Patienten tatsächlich freiwillig ihr Leben lang einmal pro Woche eine Spritze setzen möchten, um schlank zu bleiben. Wer dazu nicht bereit ist, kann auf ein orales Semaglutid des Pharmakonzerns Novo Nordisk hoffen, das in den USA bereits zugelassen wurde.
Auch andere Hersteller wie Eli Lilly arbeiten an oralen GLP-1-Agonisten (Kawai et al. 2020). Hier bleibt aber abzuwarten, inwieweit sich die Medikamente in der Praxis bewähren, weil strenge Regeln bei der täglichen Einnahme vorgeschrieben werden: Die Tablette muss auf nüchternen Magen eingenommen werden und in den darauffolgenden 30 Minuten dürfen weder Essen noch Getränke oder weitere Medikamente aufgenommen werden (Davies et al. 2017). Hinzu kommt, dass die höchste zugelassene Dosierung von Semaglutid oral (14 mg/Tag) etwas schwächer wirksam ist als die Spritze (1,0 mg Semaglutid subkutan).
Die Menge des Wirkstoffs (Semaglutid) wird in der Regel von Monat zu Monat kontinuierlich gesteigert: Es beginnt mit 0,25 Milligramm in Woche 1 und wird bis zu Woche 17 langsam immer mehr. Ab dann beträgt die maximale wöchentliche Dosis 2,4 Milligramm. Weitere Erhöhungen sind nicht empfohlen und erzielen, nach derzeitigem Studienstand, keine Effekte auf das weitere Gewichtsmanagement (Europäische Kommission 2023).
Weitere hilfreiche Links
S3-Leitlinie Chirurgie der Adipositas und metabolischer Erkrankungen. Stand 01.02.2018, aktuell in Überarbeitung, Registernummer 088-001. https://register.awmf.org/de/leitlinien/detail/088-001.
Semaglutid. Gelbe Liste (2019): https://www.gelbe-liste.de/wirkstoffe/Semaglutid_55565
„The breakthrough obesity drugs that have stunned researchers.“ McKenzie Prillaman for nature, 04.01.2023: https://www.nature.com/articles/d41586-022-04505-7
„When the Breakthrough Obesity G-Agonist Drugs Exceed Expectations“. Eric Topol for Ground Truths, 24.09-2023: https://erictopol.substack.com/p/when-the-breakthrough-g-agonists
Mehr zur Abnehmspritze
Nachweise
ACC – American College of Cardiology (2023): SELECT: Semaglutide Reduces Risk of MACE in Adults With Overweight or Obesity. ACC News Story. https://www.acc.org/Latest-in-Cardiology/Articles/2023/08/10/14/29/SELECT-Semaglutide-Reduces-Risk-of-MACE-in-Adults-With-Overweight-or-Obesity
AkdÄ – Arzneimittelkommission der deutschen Ärzteschaft (2023): Semaglutid (Wegovy®) – neue Indikation. Arzneiverordnung in der Praxis, vorab online, 27. September 2023. https://www.akdae.de/fileadmin/user_upload/akdae/Arzneimitteltherapie/NA/Archiv/202303-Wegovy.pdf
Aronne et al. (2024): Continued Treatment With Tirzepatide for Maintenance of Weight Reduction in Adults With ObesityThe SURMOUNT-4 Randomized Clinical Trial. JAMA. 2024; 331(1):38-48. DOI:10.1001/jama.2023.24945
BASG – Bundesamt für Sicherheit im Gesundheitswesen BASG (2023): Warnung vor gefälschtem Ozempic® – Update 31.10.2023. https://www.basg.gv.at/marktbeobachtung/amtliche-nachrichten/detail/update-zur-warnung-vor-gefaelschtem-arzneimittel-ozempicr-1
BfArM – Bundesinstitut für Arzneimittel und Medizinprodukte (2023): Fälschung des Arzneimittels Ozempic®: aktuelle Entwicklungen. Information vom 10.11.2023. https://www.bfarm.de/DE/Arzneimittel/Arzneimittelinformationen/Rapid-Alert-System/Arzneimittelfaelschungen/Ozempic/_node.html
Blundell et al. (2017): Effects of once‐weekly semaglutide on appetite, energy intake, control of eating, food preference and body weight in subjects with obesity. Diabetes, Obesity and Metabolism 2017; 19 (9): 1242–51. https://doi.org/10.1111/dom.12932
Davies et al. (2017): Effect of oral semaglutide compared with placebo and subcutaneous semaglutide on glycemic control in patients with type 2 diabetes: A randomized clinical trial. JAMA 2017; 318: 1460–70. DOI: 10.1001/jama.2017.14752
DAG – Deutsche Adipositas-Gesellschaft e. V. (2023): Adipositas-Medikamente: Antworten auf häufige Fragen. https://adipositas-gesellschaft.de/adipositas-medikamente-fragen-und-antworten/
Eckert N (2023): Adipositastherapie: Erstmals ein wirksames Abnehmmedikament. Dtsch Arztebl 2023; 120(33-34): A-1374 / B-1184. https://www.aerzteblatt.de/archiv/233456/Adipositastherapie-Erstmals-einwirksames-Abnehmmedikament
EMA – European Medicines Agency (2023a): EMA alerts EU patients and healthcare professionals to reports of falsified Ozempic pens. News. https://www.ema.europa.eu/en/news/ema-alerts-eu-patients-and-healthcare-professionals-reports-falsified-ozempic-pens
EMA – European Medicines Agency (2023b): Wegovy – semaglutide. Summary of opinion. https://www.ema.europa.eu/en/documents/smop/chmp-post-authorisation-summary-opinion-wegovy-ii-09_en.pdf
EMA – European Medicines Agency (2023c): Mounjaro. https://www.ema.europa.eu/en/medicines/human/EPAR/mounjaro
Europäische Kommission (2023): Wegovy: Zusammenfassung der Merkmale des Arzneimittels. https://ec.europa.eu/health/documents/community-register/2023/20230428159133/anx_159133_de.pdf
Europäische Kommission (2015): Saxenda: Zusammenfassung der Merkmale des Arzneimittels. https://ec.europa.eu/health/documents/community-register/2015/20150323131125/anx_131125_de.pdf
Gelbe Liste (2024): Lieferengpass Ozempic 1 mg Injektionslösung. https://www.gelbe-liste.de/lieferengpaesse/lieferengpass-ozempic-1mg-injektionsloesung
Hinnen D (2017): Glucagon-Like Peptide 1 Receptor Agonists for Type 2 Diabetes. Diabetes Spectrum 2017; 30 (3):202–10. https://doi.org/10.2337/ds16-0026
Hollstein T (2021): Semaglutid: Der Preis für das Abnehmen. Dtsch Arztebl 2021; 118(12): A-622 / B-524. https://www.aerzteblatt.de/archiv/218450/Semaglutid-Der-Preis-fuer-das-Abnehmen
Kawai et al. (2020): Structural basis for GLP-1 receptor activation by LY3502970, an orally active nonpeptide agonist. Proceedings of the National Academy of Sciences 2020; 117 (47): 29959–67. https://doi.org/10.1073/pnas.2014879117
Korsatko et al. (2018): »Effect of once‐weekly semaglutide on the counterregulatory response to hypoglycaemia in people with type 2 diabetes: A randomized, placebo‐controlled, double‐blind, crossover trial« Diabetes Obes Metab 20 (2018), S. 2565–2573, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6221089/.)
Kosiborod et al. (2023): Semaglutide in Patients with Heart Failure with Preserved Ejection Fraction and Obesity. N Engl J Med 2023; 389: 1069-1084. DOI: 10.1056/NEJMoa2306963
Krankenkassen Deutschland (2024): Abnehmespritzen Ozempic und Wegovy: Zahlen die Krankenkassen? Online am 26.01.2024. www.krankenkassen.de/gesetzliche-krankenkassen/leistungen-gesetzliche-krankenkassen/gesetzlich-vorgeschriebene-leistungen/neue-leistungen/abnehmespritzen/
Liu et al. (2019): Risk of Malignant Neoplasia with Glucagon-Like Peptide-1 Receptor Agonist Treatment in Patients with Type 2 Diabetes: A Meta-Analysis. Journal of Diabetes Research 2019: 1534365. https://doi.org/10.1155/2019/1534365.
Novo Nordisk (2023): Semaglutide 2.4 mg reduces the risk of major adverse cardiovascular events by 20% in adults with overweight or obesity in the SELECT trial. https://www.novonordisk.com/news-and-media/news-and-ir-materials/news-details.html?id=166301.
Pi-Sunyer et al. (2015): A Randomized, Controlled Trial of 3.0 mg of Liraglutide in Weight Management. N Engl J Med. 2015 Jul 2; 373(1): 11-22. DOI: 10.1056/NEJMoa1411892
Raccah D (2017): Safety and tolerability of glucagon-like peptide-1 receptor agonists: unresolved and emerging issues. Expert Opinion on Drug Safety, 16:2, 227–236. https://doi.org/10.1080/14740338.2017.1268598
Rubino et al. (2021): Effect of Continued Weekly Subcutaneous Semaglutide vs Placebo on Weight Loss Maintenance in Adults With Overweight or ObesityThe STEP 4 Randomized Clinical Trial. JAMA. 2021; 325(14): 1414-1425. DOI:10.1001/jama.2021.3224
Sodhi et al. (2023): Risk of Gastrointestinal Adverse Events Associated With Glucagon-Like Peptide-1 Receptor Agonists for Weight Loss. JAMA. 2023; 330(18): 1795–1797. DOI:10.1001/jama.2023.19574
Tak YJ, Lee SY (2021): Long-Term Efficacy and Safety of Anti-Obesity Treatment: Where Do We Stand? Curr Obes Rep 10, 14–30 (2021). https://doi.org/10.1007/s13679-020-00422-w
Wadden et al. (2021): Effect of Subcutaneous Semaglutide vs Placebo as an Adjunct to Intensive Behavioral Therapy on Body Weight in Adults With Overweight or Obesity. JAMA. 2021;325(14):1403-1413. https://doi.org/10.1001%2Fjama.2021.1831
Wang et al. (2024): Association of semaglutide with risk of suicidal ideation in a real-world cohort. Nat Med 30, 168–176. https://doi.org/10.1038/s41591-023-02672-2
Wester et al. (2023): Glucagon-like peptide-1 receptor agonists and risks of major averse liver outcomes in parients with chronic liver disease and type 2 diabetes. Gut Published online: http://dx.doi.org/ 10.1136/gutjnl-2023-330962
Wilding et al. (2021): Once-Weekly Semaglutide in Adults with Overweight or Obesity. N Engl J Med 2021; 384(11): 989–1002. DOI: 10.1056/NEJMoa2032183
Titelbild: aniloracru/panthermedia.net
Grafiken: Sonja Heller, www.designbrandung.de
Stand: März 2024
